Introdução: Diversas mutações do DNA mitocondrial tem sido descritas, em diferentes famílias, associadas à deficiência auditiva não sindrômica. No entanto, pouco se sabe sobrea prevalência dessas mutações em pacientes esporádicos com deficiência auditiva sensorioneural não sindrômica.
Objetivo: A finalidade do nosso estudo foi investigar a incidência dessas mutações no DNA mitocondrial nessa população.
Método: No total, 178 pacientes esporádicos com deficiência auditiva sensorioneural não sindrômica foram recrutados para participação no estudo. O DNA genômico foi extraído de amostra, de sangue periférico. Utilizamos o método de sequenciamento SNaPshot® para detecção de cinco mutações do DNA mitocondrial: A1555G e A827G no gene 12S rRNA e A7445G, 7472insCe T7511C no gene tRNASer(UCN). Paralelamente, utilizamos a reação de polimerase em cadeia e sequenciamos os produtos para triagem das mutações no gene GJB2 nos pacientes portadores de mutações no DNA mitocondrial.
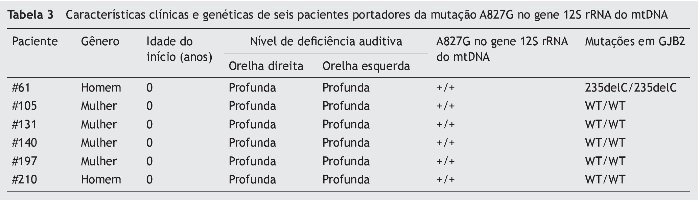
Resultados: Em nossa população, não conseguimos detectar a presença da mutação A1555G no gene 12S rRNA e nem as mutações A7445G, 7472insC e T7511C no gene tRNASer(UCN). Entretanto, constatamos que seis pacientes (3,37%) eram portadores da mutação homozigota A827G; e um deles também portava a mutação homozigota GJB2 235delC.
Conclusão: Nossos achados no presente estudo indicam que, mesmo em pacientes esporádicos com deficiência auditiva sensorioneural não sindrômica, as mutações do DNA mitocondrial também podem contribuir para o fenótipo clínico.
Introduction: Several mitochondrial DNA mutations have been reported to be associated with nonsyndromic hearing loss in several families. However, little is known about the prevalence of these mutations in sporadic patients with nonsyndromic sensorineural hearing loss.
Objective: The purpose of our study was to investigate the incidence of these mitochondrial DNA mutations in such population.
Methods: A total of 178 sporadic patients with nonsyndromic sensorineural hearing loss were enrolled in this study. Genomic DNA was extracted from the peripheral blood sample. We employed the SNaPshot® sequencing method to detect five mitochondrial DNA mutations, including A1555G and A827G in 12S rRNA gene and A7445G, 7472insC, and T7511C in tRNASer(UCN) gene.
Meanwhile, we used polymerase chain reaction and sequenced the products to screen GJB2 gene mutations in patients carrying mitochondrial DNA mutations.
Results: We failed to detect the presence of A1555G mutation in 12S rRNA gene, and of A7445G, 7472insC, T7511C mutations in tRNASer(UCN) gene in our population. However, we found that 6 patients (3.37%) were carriers of a homozygous A827G mutation and one of them also carried homozygous GJB2 235delC mutation.
Conclusion: Our findings in the present study indicate that even in sporadic patients with nonsyndromic sensorineural hearing loss, mitochondrial DNA mutations might also contribute to the clinical phenotype.
Introdução
A deficiência auditiva sensorioneural (DASN) é um dos transtornos congênitos mais comuns. Sua incidência é de aproximadamente 1/1.000 neonatos em todo o mundo.1-3 Mais de metade desses casos tem causa genética, exibindo um padrão hereditário autossômico dominante, autossômico recessivo, ligado a X, ou mitocondrial.4,5 Até a presente data, mais de 200 mutações pontuais no DNA mitocondrial (mtDNA) foram descritas no banco de dados MITOMAP6 para tais mutações. Com elas, descobriu-se que várias mutações estavam associadas às deficiências auditiva sindrômica, não sindrômica e induzida por aminoglicosídeo, sobretudo aquelas nos genes 12S rRNA e tRNASer(UCN). A1555G, que se localiza no locus A altamente conservado do 12S rRNA mitocondrial, foi a primeira mutação a ser descrita em associação com DASN. Foi constatado que essa mutação era responsável, tanto pela deficiência auditiva induzida por aminoglicosídeo, como pela deficiência auditiva não sindrômica em diversas famílias no mundo.7-10 Recentemente, descobriu-se que A827G, uma mutação homoplásmica no gene 12S rRNA do mtDNA, é responsável pela deficiência auditiva não sintomática em todos os membros ligados ao lado materno de uma família chinesa.11 Também há relatos de que A827G esteja associada tanto à ototoxicidade por aminoglicosídeo como à deficiência auditiva não sintomática em indivíduos esporádicos.12,13 Além do gene 12S rRNA, o gene mitocondrial tRNASer(UCN) está também associado à DASN, e também com a surdez não sindrômica, pois foram identificadas várias mutações, inclusive A7445G,14,15 7472insC,16 e T7511C.17,18
Apesar de as mutações do mtDNA estarem associadas em diversas famílias à DASN não sindrômica (conforme mencionado anteriormente), pouco se sabe sobre a incidência delas em pacientes esporádicos com DASN não sindrômica. Em nosso estudo anterior, nos concentramos nas mutações GJB2 e SLC26A4 em pacientes com deficiência auditiva não sindrômica autossômica recessiva (PANAR). Em consequência, verificamos que, embora os genes GJB2 e SLC26A4 sejam os mais comuns em casos de surdez, apenas pequena parte desses pacientes são portadores de mutações patogênicas homozigotas ou heterozigotas compostas.19 Isso sugere que outros genes para surdez também podem contribuir para o fenótipo clínico. No presente estudo, empregamos um método rápido, o sequenciamento SNaPshot®, para triagem de 178 pacientes esporádicos com DASN não sindrômica, com o objetivo de estimar a prevalência das mutações do mtDNA nessa população. Além disso, para identificação do papel do gene GJB2 no fenótipo de surdez, fizemos a triagem desse gene nos pacientes portadores de mutações no mtDNA.
Método
Pacientes e amostras
No total, 178 pacientes esporádicos com DASN não sindrômica participaram da investigação. Esses indivíduos eram oriundos de diversas regiões de nossa província. Cada paciente passou por um exame físico cuidadoso e, em seguida, foi registrada uma história clínica detalhada. Pacientes com histórico de dominância familiar, de exposição a aminoglicosídeo e de deficiência auditiva sindrômica foram excluídos do estudo. Todos os participantes passaram por um teste audiométrico, consistindo em resposta auditiva do tronco cerebral (RAT), emissões otoacústicas (EOA) e timpanometria. O nível do comprometimento auditivo foi definido como normal (< 26 dB), leve (26-40 dB), moderado (41-70 dB), grave (71-90 dB) e profundo (> 90 dB). Obtivemos amostras de sangue periférico dos pacientes para isolamento do DNA genômico.
Obtivemos consentimento informado dos pacientes adultos e dos pais das crianças participantes. O presente estudo foi aprovado pelo Comitê de Ética local (nº de aprovação do Comitê de Ética: 2013-007).
Sequenciamento com SNaPshot®
Uma mistura final para reação de RCP com 20 μl continha 1x GC Buffer I, 3,0 mM Mg2+; 0,3 mM dNTPs, 1U de HotStarTaq polimerase, 10 ng de template de DNA, e uma mistura de primers com 1 μM contendo dois pares de primers para amplificação de cinco regiões de mutação (tabela 1). As condições para RCP foram: 95ºC x 2 min; 11 ciclos de 94ºC x 20 s, 65ºC-0,5ºC por ciclo x 40 s, 72ºC x 90 s; 24 ciclos de 94ºC x 20 s, 59ºC x 30 s, 72ºC x 90 s; e 72ºC x 2 min. Para a purificação dos produtos de RCP, 5U de fosfatase alcalina de camarão (SAP) (Promega) e 2U de Exonuclease I (Epicentre) foram adicionados a 15 μl de produtos do RCP. A mistura foi incubada a 37ºC 3 60 min e, em seguida, incubada a 75ºC x 15 min.
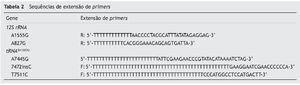
A extensão de base única (single base extension, SBE) foi realizada em uma mistura de reação final de 10 μl, contendo 5 μl de SNaPshot®Multiplex Kit (Applied Biosystems), 2 μl de produto de reação RCP multiplex purificado, e 0,8 μM de mistura de extensão de primers (tabela 2). O programa da reação consistiu em 96ºC x 1min; 28 ciclos de 96ºC x 10 s, 52ºC x 5 s, 60ºC x 30 s; 4ºC permanentemente. Em seguida, os produtos de SBE foram purificados com o uso de SAP. Para análise das sequências, os produtos SBE multiplex purificados foram misturados com 0,5 μl de 120 LIZ®dye Size Standard (Applied Biosystems) e 9 μl de Hi-Di® (Applied Biosystems) e desnaturados a 95ºC x 5 min. Em seguida, os produtos foram sequenciados pelo sequenciador ABI 3730xl DNA. Os dados foram analisados pelo software GeneMapper v4.1 (Applied Biosystems).
Detecção da mutação GJB2 pela reação de polimerase em cadeia
Dois éxons de GJB2 foram amplificados pela reação de polimerase em cadeia (PCR, Polimerase chain reaction). Os primers estão listados na tabela 1. A amplificação da RCP e subsequente purificação foram realizadas conforme descrição anterior.19 Os produtos purificados da PCR foram sequenciados com o uso do método de terminadores de cadeia (didesoxi) em um sequenciador ABI 3730xl DNA (Applied Biosystems) com o kit de sequenciamento de ciclos ABI Big-Dye® Terminator v3.1 (Applied Biosystems), de acordo com os protocolos do fabricante. Os primers foram os mesmos utilizados para a amplificação por PCR.
Resultados
As amostras em estudo foram compostas por 82 indivíduos do gênero masculino e 96 do gênero feminino. A idade dos participantes variou de nove meses até 37 anos, com uma média de idade de 5,53 ± 4,44 anos. Os resultados dos testes audiométricos revelaram envolvimento coclear em todos os participantes e, além disso, todos sofriam de comprometimento auditivo sensorioneural bilateral grave (71-90 dB) a profundo (> 90 dB)
Em nenhum dos 178 pacientes esporádicos com DASN não sindrômica foi possível detectar a presença das mutações A7445G, 7472insC e T7511C no gene tRNASer(UCN). Além disso, não detectamos a mutação A1555G no gene 12S rRNA nessa população. No entanto, a variante A827G no gene 12S rRNA foi observada em seis pacientes, e todos eram portadores de mutação homozigota. Para esclarecimento do papel do gene GJB2 na expressão fenotípica nos indivíduos com mutações do mtDNA, fizemos a triagem das mutações do gene GJB2 nos participantes portadores da mutação A827G. Em consequência, apenas um paciente era portador de mutação patogênica no gene GJB2, que apresentava homozigose para 235delC (tabela 3).
Discussão
Quase todos os estudos previamente publicados se centraram na associação entre as mutações do mtDNA e a população com deficiência auditiva não sindrômica e/ou induzida por aminoglicosídeo.12,19 Já foi identificado que várias mutações do mtDNA, por exemplo, A1555G e A827G no gene 12S rRNA, e A7445G, 7472insC e T7511C no gene tRNASer(UCN), estão associadas a tais populações.10,13,14,19,20 Mas, frequentemente, essas mutações não são suficientes para produzir o fenótipo clínico.14,19 À semelhança de outros estudos, constatamos, em nosso estudo precedente, que, em pacientes com PANAR, cerca de 30-40% deles eram portadores de mutações patogênicas nos genes mais comuns para surdez, mas praticamente 40% eram portadores de mutação heterozigota. Assim, outras mutações gênicas podem, no conjunto, contribuir para o fenótipo. Embora uma associação entre mutações do mtDNA e deficiência auditiva não sindrômica tenha sido identificada em várias famílias, pouco se sabe sobre a prevalência das mutações de mtDNA em pacientes esporádicos com DASN não sindrômica.
Mutações no DNA mitocondrial em genes do tRNA podem causar modificação no tRNA e falhas no seu metabolismo; com isso, a síntese proteica fica comprometida e ocorre redução da síntese do ATP – eventos considerados como os principais fatores patogênicos.21-25 A mutação A7445G foi originalmente identificada em uma família com surdez não sindrômica.26 Essa mutação acarreta o defeito de processamento endonucleolítico do terminal 3’ na fita L do precursor policistrônico de RNA.27 Em consequência, a mutação A7445G pode causar uma redução superior a 50% no nível de tRNASer(UCN) e decréscimo na síntese de proteína, desempenhando papel determinante no fenótipo respiratório das linhagens de células mutantes.28,29 A mutação 7472insC foi originalmente descrita por Tiranti et al., sendo provável ela que altere a estrutura da alça T (psi) C na estrutura secundária de folha de trevo de tRNASer(UCN); além disso, ficou comprovado que essa mutação prejudica o processamento de tRNASer(UCN), tanto no terminal 5’ como no terminal 3’, e causa uma queda no nível de equilíbrio de tRNASer(UCN).16,24,30 Foi determinado que a mutação T7511C está associada à deficiência auditiva não sindrômica em várias famílias de diferentes etnias.17,18,31
Essa mutação pode afetar o processamento da fita L do precursor de RNA, abrangendo tRNASer(UCN) e ND6 mRNA, especificamente, no terminal 5’ do tRNA.23,32 Como resultado, a mutação T7511C provoca redução no nível do gene tRNASer(UCN), com comprometimento na síntese proteica mitocondrial.22,28 Embora tenha sido observado que essas mutações no gene tRNASer(UCN) estão associadas a pacientes com deficiência auditiva não sindrômica e/ou induzida por aminoglicosídeo, muitos estudos não conseguiram detectar tais mutações nessas populações. Xing et al. analisaram a caracterização molecular de uma família chinesa com deficiência auditiva induzida por aminoglicosídeo e não sindrômica, mas não detectaram as mutações A7445G, 7472insC e T7511C no gene tRNASer(UCN).33 Em uma família argentina com deficiência auditiva induzida por aminoglicosídeo, essas mutações também não foram detectadas.34 Ademais, Li et al. realizaram uma análise molecular em 164 caucasianos sem vínculo de parentesco com deficiência auditiva não sindrômica, e não conseguiram detectar a presença das mutações A7445G, 7472insC e T7511C no gene tRNASer(UCN).12 Abreu-Silva et al. também não detectaram essas mutações em 203 pacientes brasileiros não selecionados com deficiência auditiva.35 Até a presente data, pouco se sabe sobre a incidência dessas mutações no gene tRNASer(UCN) em pacientes esporádicos portadores de DASN não sindrômica. No presente estudo, exploramos essas mutações em tal população, mas não foi possível detectar portadores das mutações no gene tRNASer(UCN).
A mutação A1555G gera um par específico de bases GC, o que faz com que a estrutura secundária do 12S rRNA se assemelhe mais de perto com a região correspondente do 16S rRNA de E. coli e ligue aminoglicosídeos com grande afinidade.36 Portanto, os pacientes portadores dessa mutação podem se apresentar com DASN em seguida ao uso de aminoglicosídeos.13 Entretanto, estudos já publicados identificaram que a mutação A1555G no 12S rRNA está também associada à deficiência auditiva não sindrômica,9,10 embora sua incidência em indivíduos com essa deficiência seja muito menor do que em casos de deficiência auditiva por aminoglicosídeo. Lu et al. informaram que as incidências da mutação A1555G foram, respectivamente, 1,43 e 10,41%, em uma população pediátrica chinesa com deficiência auditiva não sindrômica e induzida por aminoglicosídeo.19 Nessa mesma linha, Rydzanicz et al. observaram incidências de 5,5 e 1,6%, respectivamente, nas coortes com deficiência auditiva induzida por aminoglicosídeo ou não sindrômica em uma população polonesa.37 Em uma população pediátrica caucasiana com deficiência auditiva não sindrômica, a frequência da mutação A1555G foi de 0,6%.12 Neste estudo, verificamos que nenhum dos participantes era portador da mutação A1555G. Em comparação com relatos anteriores, a incidência dessa mutação em nossa população com DASN não sindrômica é relativamente mais baixa.
A mutação A827G, assim como a A1555G, localiza-se no sítio A do gene 12S rRNA mitocondrial que, em termos evolucionários, é altamente conservado em diferentes espécies.34 É possível que a alteração da estrutura terciária ou quaternária do 12S rRNA pela mutação A827G possa levar à disfunção mitocondrial e, com isso, a mutação desempenharia um papel na patogênese da deficiência auditiva.11,34 A patogênese dessa mutação foi identificada em uma família chinesa com deficiência auditiva não sindrômica.11 Embora a mutação A827G também tenha sido detectada em controles com audição normal,19 um número maior de estudos a consideram uma mutação patogênica, dependendo da localização e da ausência nos controles nesses estudos.11-13,34,37 Por outro lado, eles também detectaram uma penetrância incompleta da mutação A827G, sugerindo que apenas a presença da mutação não é suficiente para produzir o fenótipo clínico,11,34 e que, portanto, alguns indivíduos com audição normal e portadores da mutação A827G podem ter seu quadro atribuído à penetrância incompleta. Em nosso estudo, constatamos que 3,37% (6/178) dos pacientes são portadores da mutação A827G homozigota. Em outra população pediátrica esporádica chinesa com deficiência auditiva não sindrômica, a incidência foi de 4,41%.13 A incidência da mutação A827G nessa população chinesa parece ser mais alta do que em outros grupos étnicos.11,37 Como demonstraram estudos anteriores – que a expressão do fenótipo clínico de mutações homoplásmicas associadas à surdez no gene 12S rRNA depende da contribuição de fatores moduladores, como, por exemplo, aminoglicosídeos ou genes nucleares modificadores, e que o gene GJB2 é um potencial candidato de gene modificador –,12,38-40 realizamos uma triagem mutacional do gene GJB2 nos pacientes portadores da mutação A827G. Como resultado, apenas um paciente era portador tanto da mutação A827G do gene 12S rRNA, como da mutação 235delC homozigota do gene GJB2. A inexistência da mutação no gene GJB2 em alguns indivíduos sugere que outros genes modificadores nucleares e outros fatores ambientais podem contribuir para o fenótipo clínico nesses pacientes.
Conclusão
No presente estudo, realizamos a triagem de mutações de mtDNA em pacientes esporádicos com DASN não sindrômica e encontramos um total de seis (3,37%) portadores de mutações homozigotas de mtDNA. Nossos achados sugerem que pacientes esporádicos com DASN não sindrômica também são portadores de mutações de mtDNA, e que essas mutações podem contribuir para o fenótipo clínico. Novos estudos envolvendo a triagem das mutações no mtDNA seriam de grande utilidade para melhor compreensão da prevalência e do papel das mutações de mtDNA em pacientes esporádicos com DASN não sindrômica.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Esse estudo foi financiado por bolsas do Departamento de Saúde Pública (nº 2011ZDA012) e pelo Departamento de Ciência e Tecnologia (nº 2014C37036).
Recebido em 29 de março de 2015;
aceito em 6 de junho de 2015
* Autor para correspondência.
E-mail: yangbb1959@sina.com (B.-B. Yang).
DOI se refere ao artigo: http://dx.doi.org/10.1016/j.bjorl.2015.06.006
☆ Como citar este artigo: Jiang H, Chen J, Li Y, Lin P-F, He J-G, Yang B-B. Prevalence of mitochondrial DNA mutations in sporadic patients with nonsyndromic sensorineural hearing loss. Braz J Otorhinolaryngol. 2016;82:391-6.